2207 2016-2
jueves, 3 de marzo de 2016
Endocitosis Equipo 3
Equipo 3
Lara Mendez Karla Angélica
Moreno Zamora Roberto Alexander
Hernandez Silva Jessica Lizet
Salazar Tellez Emmanuel
Lopez Hernandez Tania Monserrat
MECANISMOS DE ENTRADA DE VIRUS:
UNA MANERA DE CONOCER A LA CÉLULA
Michelle Gutiérrez* y Susana López
Depto. de Genética del Desarrollo y Fisiología Molecular,
Instituto de Biotecnología, UNAM, Cuernavaca, Morelos,
México. C. P. 62210. E-mail*: mayret@ibt.unam.mx
RESUMEN
Los virus representan una versión microscópica del caballo de Troya, en la que hacen uso de procesos celulares
para poder entrar a la célula e infectarla. La endocitosis es uno de estos procesos que los virus han aprovechado
para poder ser internalizados. En esta revisión se presentan las distintas vías de endocitosis conocidas hasta el
momento, así como ejemplos de distintos virus que utilizan cada ruta para ingresar a la célula.
Palabras Clave: Caveolas, clatrina, dinamina, endocitosis, entrada de virus.
ABSTRACT
Viruses represent a microscopic version of the Trojan horse by mimicking processes known to the cell to get inside
and infect it. Endocytosis is one of these processes that viruses take advantage of to be internalized. In this
review, the distinct endocytic pathways known to date are discussed. In addition, a brief overview of the entry
of different viruses known to use each of these routes is provided.
Key Words: Caveolae, clathrin, dynamin, endocytosis, virus entry.
INTRODUCCIÓN
La endocitosis es el proceso mediante el cual ingresan
a la célula solutos, moléculas y partículas de distintos
tipos. Este proceso consiste en la invaginación de la
membrana plasmática, formando una vesícula cuyo
contenido es transportado del exterior al interior de la célula. La
endocitosis tiene un papel fundamental en diferentes procesos
celulares como son la respuesta inmune, la comunicación
intercelular, la transducción de señales y la homeostasis, tanto
celular como del organismo completo.
Este proceso celular está constituido por una red de varios
organelos los cuales difieren en su composición proteica y
propiedades bioquímicas
Existen diferentes rutas de endocitosis que son usadas por la
célula para llevar a cabo distintas funciones. Sin
embargo, dados los avances metodológicos recientes, así como
la complejidad de este proceso, se siguen encontrando nuevas
rutas cuya caracterización es aún incompleta.
Existen varios criterios para clasificar los diferentes tipos de
endocitosis, éstos son: el tipo de molécula que se internaliza
(toxina, virus, ligando, receptor), el componente que cubre la
vesícula (clatrina, caveolina, flotilina, etc.), la participación de
GTPasas en el proceso, el mecanismo de escisión de la vesícula
de la membrana y la participación del citoesqueleto de actina,
entre otros.
La presencia de las GTPasas de la familia Rab contribuye a la
diferenciación entre los distintos tipos de endosomas. Estas
GTPasas son importantes en la regulación del tráfico intracelular
porque regulan la fusión de las vesículas a los endosomas. De
manera general, la unión del ligando al receptor favorece la
formación de la vesícula endocítica. Esta vesícula entrega su
cargo a los endosomas tempranos (o endosomas de distribución),
organelos con un pH alrededor de 6 donde se localizan las Rab
GTPasas 4 y 5. En los casos donde la molécula endocitada es un
receptor unido a su ligando, el pH ácido puede promover la disociación del ligando de su receptor. Usualmente, el ligando,
el cual permanece en la vía, es degradado, mientras que el
receptor entra a los endosomas de reciclamiento (donde está
localizada Rab11) para regresar a la membrana celular. Las
moléculas que son destinadas a su degradación o que requieren
llegar al interior celular, cerca del núcleo, entran a los endosomas
tardíos (también conocidos como cuerpos multivesiculares -
MVBs-). En estos organelos, con un pH menor a 6, se localiza la
GTPasa Rab 7. Finalmente, la molécula endocitada llega a los
lisosomas donde puede ser degradada por enzimas que están
activas en un ambiente ácido. En el transcurso de toda la ruta
endocítica, existen posibles rutas de escape para evitar la
degradación en los lisosomas (Figura 1).
A continuación se da una breve descripción de las rutas más
conocidas hasta el momento que han sido clasificadas de
acuerdo a las proteínas que recubren las vesículas endocíticas.
Endocitosis mediada por clatrina
La endocitosis mediada por clatrina es el mecanismo mejor
caracterizado para la entrada de moléculas a la célula. Este tipo
de endocitosis requiere una serie de componentes estructurales
para poder formar la vesícula de manera que pueda ser
internalizada. Uno de estos componentes, y por el cual esta vía
recibe su nombre, es la clatrina.
La clatrina es un complejo proteico formado por tres cadenas
ligeras y tres cadenas pesadas que constituyen una unidad
llamada "el triesqueleto" (triskelion) de clatrina3
. Este complejo
es reclutado a la membrana plasmática por proteínas adaptadoras.
Una de estas proteínas adaptadoras, es el complejo AP-2,
formado por cuatro subunidades (α, β2, µ2 y σ2). El complejo AP-
2 interactúa con clatrina, a través de la subunidad β2, y estimula
su polimerización generando una malla de clatrina que cubre la
vesícula (Figura 2)4
. Durante el ensamble progresivo de clatrina
en la membrana, ésta va adquiriendo curvatura hasta que se
forma la vesícula endocítica. La fisión de la vesícula cubierta con
clatrina es controlada por la GTPasa dinamina. Se ha propuesto
que la dinamina actúa como una mecano-enzima la cual usa la
hidrólisis de GTP para generar la fuerza necesaria para estrangular
el cuello y escindir las vesículas de la membrana (Figura 2)5
.
Existen diferentes maneras de inhibir esta vía de endocitosis.
Desde agentes químicos como sacarosa o clorpromazina hasta
siRNAs o mutantes dominantes negativas de los componentes
estructurales de la vía.
Endocitosis mediada por caveolas
La segunda vía de endocitosis mejor caracterizada es la mediada
por caveolas. En esta ruta, las caveolinas son el principal
componente estructural. A diferencia de clatrina que requiere proteínas accesorias para ser reclutada a la membrana, las
caveolinas son proteínas integrales que están asociadas a
microdominios en la membrana plasmática ricos en colesterol y
esfingolípidos también llamados balsas lipídicas6
. La formación
de la caveola depende de la expresión de caveolina-1 en células
no musculares y de caveolina-3 en células de músculo6
. Estas
proteínas forman oligómeros que cubren las vesículas, las cuales
son liberadas de la membrana plasmática, a través de la acción
de dinamina, a estructuras llamadas caveosomas presentes en el
interior de la célula (Figura 1)7
. La ausencia de marcadores para
endosomas tempranos, tardíos y de reciclaje indica que estas
estructuras representan un nuevo tipo de organelos7
. A diferencia
de los endosomas, estos organelos tienen pH neutro.
El tratamiento de las células con genisteína, un inhibidor de
tirosín cinasas extraído de la soya, bloquea la invaginación de las
caveolas8
. Se sabe que la cinasa Src fosforila a la caveolina-1 en
la tirosina 14 y esto incrementa la dinámica de las caveolas.
Endocitosis como vía de entrada de virus
Los virus son parásitos intracelulares obligatorios formados
por una cubierta proteica (cápside) que rodea el material genético.
Algunos virus tienen además, una envoltura lipídica proveniente
de la célula que infectó previamente rodeando su cápside. El
ciclo replicativo de cualquier virus comienza con la unión de éste
a sus receptores (entre ellos integrinas, gangliósidos,
glicoproteínas, etc.) lo cual provoca cambios en la partícula viral
que favorecen las siguiente etapas. Una vez que el virus ha
reconocido a sus receptores, el siguiente paso es la penetración
de la membrana celular. Este paso puede darse a nivel de la
membrana plasmática o en membranas intracelulares de
diferentes organelos dependiendo de los requerimientos de
cada virus. Muchos virus utilizan las vías de endocitosis para
entrar a la célula, mientras que pocos atraviesan directamente
la membrana celular por un mecanismo llamado penetración directa (Figura 3). Cabe señalar que la jornada de un virus no
termina cuando llega al interior de la célula, a partir de ese
momento, la partícula viral requiere desnudarse, es decir, liberar
el genoma viral para que pueda ser replicado o traducido.
Finalmente, las proteínas virales se ensamblan para generar
nuevas partículas virales que salen de la célula y son capaces de
infectar a otras células.
En esta revisión nos enfocaremos a la entrada viral que es la
primera etapa del ciclo replicativo de un virus. Específicamente,
nos referiremos a las distintas rutas endocíticas que utilizan los
virus para ingresar a la célula. Esta fase inicia desde que el virus
se une a sus receptores celulares hasta que llega a su sitio de
replicación, el cual puede ser desde el citoplasma hasta el núcleo.
Este proceso involucra varios pasos (unión, penetración y
desnudamiento de la partícula viral) y en el que es necesaria una
cápside metaestable que, por un lado, sea resistente para sobrevivir
en ambientes extracelulares y que, por otro lado, sea fácil de
desensamblarse una vez llegado al sitio apropiado de replicación
para liberar su material genético.
La entrada de un virus utilizando el proceso endocítico de la
célula le da varias ventajas. Primero, evita la barrera del
citoesqueleto de actina cortical que se encuentra inmediatamente
debajo de la membrana plasmática y forma una malla difícil de
atravesar. Y por otra parte, le da acceso a los organelos endocíticos
los cuales proveen de micro-ambientes que favorecen la
penetración viral. Las proteasas endosomales o el bajo pH de
estos organelos son algunos de los recursos más usados por los
virus para facilitar procesos tales como el desnudamiento de la
partícula.
LINK DEL ARTÍCULO COMPLETO: http://www.medigraphic.com/pdfs/revespciequibio/cqb-2010/cqb101c.pdf
miércoles, 2 de marzo de 2016
Equipo 10.
Cervantes Mora María Fernanda
Gutiérrez Ruíz Pamela Paola
Landa Barceinas Aranza
Pérez Serrano Julissa
Ramírez Palomares Fernando Ivan

Cervantes Mora María Fernanda
Gutiérrez Ruíz Pamela Paola
Landa Barceinas Aranza
Pérez Serrano Julissa
Ramírez Palomares Fernando Ivan
LÍPIDOS DE MEMBRANA
En su composición intervienen ácidos grasos y otros componentes como alcoholes, glúcidos, ácido fosfórico, derivados aminados etc.
Son moléculas anfipáticas con una zona hidrófoba, en la que los ácidos grasos están unidos mediante enlaces ester a un alcohol (glicerina o esfingosina), y una zona hidrófila, originada por los restantes componentes no lipídicos que también están unidos al alcohol.
Encontramos los siguientes tipos:
| - Glicerolípidos | a) Gliceroglucolípidosb) Glicerofosfolípidos (fosfolípidos) |
| - Esfingolípidos | a) Esfingoglucolípidosb) Esfingofosfólípidos |
1.- Glicerolípidos.
Poseen dos moléculas de ácidos grasos mediante enlaces ester a dos grupos alcohol de la glicerina (posiciones  y
y  ). Según sea el sustituyente unido al tercer grupo alcohol de la glicerina se forman los:
). Según sea el sustituyente unido al tercer grupo alcohol de la glicerina se forman los:
a) Gliceroglucolípidos. Si se une un glúcido. Lípidos que se encuentran en membranas de bacterias y células vegetales.
b) Fosfolípidos. Se une el ácido fosfórico y constituye el ácido fosfatídico.
La estructura de los distintos Fosfolípidos se pueden considerar derivados del ácido fosfatídico, y por ello se nombran con el prefijo fosfatidil seguido del nombre del derivado aminado o polialcohol con el que se une. Así se obtienen los derivados fosfatidiletanolamina, fosfatidilcolina (lecitina), fosfatidilserina, fosfatidilglicerol y fosfatidilinositol.
Los Fosfolípidos tienen un gran interés biológico por ser componentes estructurales de las membranas celulares.
2.- Esfingolípidos. Todos ellos poseen una estructura derivada de la ceramida (formada por un ácido graso unido por enlace amida a la esfingosina).
Pueden ser de dos clases:
a)Esfingoglucolípidos. Resultan de la unión de la ceramida y un conjunto de monosacáridos como la glucosa y galactosa entre otros.
Los más simples se denominan cerebrósidos y sólo tienen un monosacárido (glucosa o galactosa) unida a la ceramida. Los más complejos son los gangliósidos, que poseen un oligosacárido unido a la ceramida.
Estas moléculas forman parte de las membranas celulares y especialmente de la plasmática, donde se intercalan con los fosfolípidos.
b) Esfingofosfolípidos. El grupo alcohol de la ceramida se une a una molécula de ácido ortofosfórico que a su vez lo hace con otra de etanolamina o de colina. Así se originan las esfingomielinas muy abundantes en el tejido nervioso, donde forman parte de las vainas de mielina.
Bibliografía:
- Mader S. Sylvia, 2007. Biología, Novena Edición. Editorial McGraw-Hill Companies, Inc. México, D.F. Pág 84 – 93.
- http://recursos.cnice.mec.es/biosfera/alumno/2bachillerato/biomol/contenidos14.htm
Equipo 11-Proteínas
Membrana Plasmática
Proteínas de la Membrana Plasmática:
La cantidad de proteínas en las membranas celulares, expresada en porcentaje, varía según los tipos celulares y los compartimientos. Esta cantidad por ejemplo, está elevada en el eritrocito y el hepatocito (50% aprox.) y es menor en la mielina (20% aprox.). La membrana de ciertos organoides es más rica en proteínas que la membrana plasmática; esto se explica por las funciones numerosas y diversas que desempeñan las proteínas que caracterizan dichos organoides.
Se clasifican en:
1.- Proteínas Intrínsecas.
2.- Proteínas Extrínsecas o periféricas.
Proteínas Intrínsecas:
Están unidas a la bicapa lipídica de una manera muy estrecha , mediante enlaces covalentes y se subdividen en tres categorías:
1.- Proteína transmembrana a uno o varios pasos (en alfa hélice). Están glicosiladas en el extremo extracelular. Generalmente son RECEPTORES.
2.- Proteína ligada a uno o varios ácidos grasos (en la hoja interna). Como ejemplo de esta categoría se cita la PROTEÍNA G.
3.- Proteína ligada a un lípido de la bicapa (fosfatidil-inositol) mediante un oligosacárido (en la hoja externa). Como ejemplo tenemos las moléculas de adhesión neuronal (NCAM).
Proteínas Extrínsecas:
Tambien denominadas periféricas, nunca establecen uniones covalentes con la bicapa lipídica, por el contrario, se unen a las proteínas intrínsecas por medio de uniones más débiles (puentes de hidrógeno...).
Las proteínas periféricas situadas en la cara citosólica de la membrana casi nunca están glicosiladas, mientras que las de la cara externa si lo están.
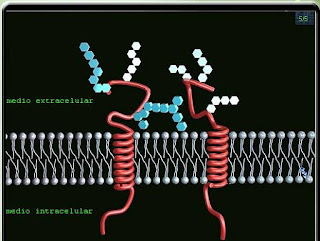
En esta imagen apreciamos varios tipos de proteínas de la membrana:
-Una proteína integral con tres segmentos transmembrana en alfa hélice.
-Una proteína integral anclada a la bicapa por medio de un ácido graso en la cara citosólica de la bicapa.
-Dos proteínas periféricas citosólicas asociadas a las proteínas integrales.
Esta proteína integral posee 7 segmentos transmembrana en alfa hélice y representa un receptor acoplado a una PROTEÍNA G.
Este tipo de receptor forma parte de una gran FAMILIA de receptores membranales con más de 100 miembros.
Participan en las repuestas de las células a moléculas informativas de una gran diversidad, tales como HORMONAS, neurotransmisores y mediadores locales.
La rodopsina, receptor presente en los bastores de la retina, pertenece a este tipo.
La imagen muestra otro tipo de proteína integral en la cara extracelular de la membrana, anclada a la bicapa gracias a un oligosacárido (hexágonos en azul claro) y un lípido del tipo fosfatidil-inositol.
Generalmente, las proteínas intrínsecas transmembrana poseen radicales glucídicos en la porción extracelular, constituyendo las Glucoproteínas de la membrana.
Este tipo de moléculas complejas, en conjunto, forman lo que se conoce conoce con el nombre de Cubierta Celular o Glucocáliz.
Fuentes de consulta.
http://www.medic.ula.ve/histologia/anexos/celulavirtual/membranaplasmatica/proteinas.htm
Integrantes de equipo:
Barrón Ruiz David Jhovanny
González Mendoza María de los Ángeles
Rivera Vázquez Elizabeth Ameyali
Rodríguez Valencia Luis Ángel
Zamora Vega Alejandra Valeria
LA MEMBRANA PLASMÁTICA: MODELOS, BALSAS Y SEÑALIZACIÓN*
Ulises Meza, Ana Catalina Romero-Méndez, Yamhilette Licón y Sergio Sánchez-Armáss
RESUMEN La membrana plasmática es la estructura que delimita a la célula. Inicialmente conceptualizada como una barrera inerte, divisoria del interior y exterior celular, en la actualidad se le reconoce como un elemento dinámico y fundamental en el mantenimiento de la integridad de la célula. Su plétora de componentes lipídicos y proteicos propicia su participación en muy diversos e importantes procesos por ejemplo: transporte y permeabilidad selectiva de sustancias e iones, excitabilidad, movilidad, diferenciación, exocitosis, reconocimiento intercelular y transducción de señales extracelulares. La presente revisión incluye un breve recuento de los principales modelos que han conducido a la concepción actual de su estructura y de sus propiedades funcionales y destaca las implicaciones del modelo vigente de balsas de membrana en procesos de señalización intracelular.
ABSTRACT The plasma membrane is the structure that delimits the cell. Originally, it was just considered a physical barrier that separates the inside from the outside of the cell. But now, it is visualized as a dynamic structure, enclosing diverse lipids and proteins elements, which is involved in several important processes e.g., ion permeability and transport, excitability, cell migration, hormone and neurotransmitter secretion, extracellular signal transduction, cell differentiation, and cell to cell recognition. This review contains a brief overview of the development of the plasma membrane concept, including its current model that involves the dynamic nanoscale heterogeneities denominated membrane rafts. The functional relevance of membrane rafts is also discussed. *Recibido: 14 de junio de 2010 Aceptado: 28 de octubre de 2010 REB 29(4): 125-134, 2010 125 PALABRAS CLAVE: Balsas lipídicas, caveolas, señalización, colesterol Departamento de Fisiología. Facultad de Medicina. Universidad Autónoma de San Luis Potosí. Av. Venustiano Carranza # 2405. San Luis Potosí, SLP. CP. 78210. México. Correo E: umeza@uaslp.mx, armass@uaslp.mx KEY WORDS: Lipid rafts, caveolae, signaling, cholesterol LA MEMBRANA
PLASMÁTICA: MODELOS, BALSAS Y SEÑALIZACIÓN* 1. Origen y desarrollo del concepto de membranas biológicas Una de las primeras referencias al concepto de membrana biológica se adjudica al botánico alemán Pfeffer (1887) (1), quien lo habría postulado al describir la similitud del comportamiento osmótico entre células y membranas artificiales (Tabla 1). En particular, Pfeffer observó que las propiedades osmóticas exhibidas por las membranas de algunos tipos de células vegetales semejaban a las de las membranas obtenidas al precipitar ferrocianuro cúprico sobre paredes porosas de cerámica. Posteriormente, Overton (1899) (1) demostró que las sustancias lipofílicas penetraban la célula con mayor facilidad que aquellas que no lo eran, lo que le llevó a concluir que la estructura que delimita a la célula debería estar constituida por una capa lipídica. Más tarde, el valor de la capacitancia eléctrica de la membrana plasmática fue reportado. En este sentido, Fricke (1923) (2) determinó el valor de 1.0 µF·cm-2 para la membrana de eritrocitos, mientras que en otros tipos celulares el valor fluctuó entre 1.0 y 6.0 µF·cm-2. Esta aparente inconsistencia fue adjudicada a la variabilidad en el espesor de las membranas analizadas. En su estudio clásico, Gorter y Grendel (1925) (3) determinaron el valor del área ocupada por los lípidos extraídos a partir 126 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S Año Autores Observación Ref. 1887 Pfeffer Similitud del comportamiento osmótico entre células vegetales y membranas artificiales. 1 1899 Overton Naturaleza lipídica de la membrana plasmática. 1 1923 Fricke Determinación del valor de capacitancia eléctrica específica de la membrana plasmática. 2 1925 Gorter y Grendel Organización de los lípidos de la membrana plasmática en bicapa. 3 1934 Danielli y Harvey Presencia de proteínas en la membrana plasmática. 4 Danielli y Davson Teoría paucimolecular de las biomembranas. 5 1959 Robertson Teoría unitaria de las membranas biológicas. 6 1972 Singer y Nicolson Modelo del mosaico fluido. 7 1975 Chapman Segregación de dominios lipídicos en el plano lateral de la membrana. 8 1988 Simons y van Meer Existencia de microdominios de esfingolípidos. 14 1997 Simons e Ikonen Modelo de balsas lipídicas e importancia del colesterol como elemento de las mismas. 15 2002 Anderson y Jacobson Incorporación de proteínas a balsas lipídicas a través de un proceso jerárquico. 24 Zacharias y cols. Presencia de nanodominios lipídicos en la monocapa interna de la membrana plasmática sin correspondencia necesaria con balsas lipídicas en la capa externa. 16 2006 Pike Sustitución del concepto de balsa lipídica por el de balsa de membrana. 17 2010 Ligwood y Simons Revaloración del modelo de balsas como principio organizador de las funciones de las membranas biológicas. 20 TABLA 1 CRONOLOGÍA DEL MODELO DE LA MEMBRANA PLASMÁTICA de la membrana plasmática de eritrocitos e inesperadamente, encontraron que dicho valor correspondía al doble del de la superficie calculada para un número conocido de estas células (asumiendo una forma discoidal para ellas). Estos investigadores infirieron, acertadamente, que la membrana de los eritrocitos está constituida por una bicapa de lípidos con un espesor de 5.0 – 6.0 nm. Posteriormente, al comparar la tensión superficial de la membrana plasmática de ovocitos de erizo de mar (0.2 dinas·cm-1) con la de una interfase artificial lípidosolución acuosa (10.0 -15.0 dinas·cm-1), Danielli y Harvey (1934) (4) evidenciaron el requerimiento de un factor adicional que explicaba la atenuación de este parámetro en las membranas biológicas, el cual adjudicaron a la presencia de proteínas. Otro avance significativo en la consolidación del concepto de biomembrana se atribuye a Danielli y Davson (1934) (5), quienes propusieron la teoría paucimolecular de la membrana, según la cual las membranas biológicas presentan un grupo mínimo de constituyentes moleculares que incluye: una región central de naturaleza lipídica no polar y espesor variable, bordeada (a ambos lados) por una monocapa de fosfolípidos cuyos extremos polares estarían orientados hacia el exterior y una monocapa más externa de proteínas globulares. En 1959, Robertson (6) postuló la denominada teoría unitaria de la membrana, la cual establece que todas las membranas biológicas están constituidas por una REB 29(4): 125-134, 2010 La membrana plasmática: modelos, balsas y señalización 127 bicapa lipídica. El sustento de esta propuesta fueron imágenes de membranas celulares obtenidas por microscopía electrónica en las que era posible distinguir una región intermedia de baja densidad electrónica delimitada por estructuras periféricas de mayor densidad; la región intermedia correspondía a las cadenas hidrocarbonadas de los lípidos y las estructuras periféricas a los grupos hidrófilos de los lípidos y/o a las proteínas asociadas. El aná- lisis detallado de este tipo de imágenes permitió a Robertson hacer extensivo su modelo al conjunto de membranas intracelulares. El modelo unitario establecía, adicionalmente, que los componentes proteicos se alojan principalmente sobre las superficies de la bicapa lipídica y sólo una proporción muy reducida de su estructura se localiza en la región central hidrófoba de la membrana. Aún cuando este modelo definía a la bicapa lipídica como una barrera al libre flujo de iones y moléculas hidrófilas, no descartaba la posible presencia de canales acuosos a través de los cuales pudiese darse el transporte de estos materiales. Esto último, bajo la condición de que dichos canales, de existir, deberían expresarse en muy baja densidad ya que su presencia difícilmente era detectable en las micrografías electrónicas. 1.1. Propiedades dinámicas de las biomembranas Los modelos hasta aquí mencionados se refieren, básicamente, a las características estructurales estáticas de las membranas biológicas. Y no fue sino hasta finales de los años sesentas cuando surge el concepto de fluidez de membrana que incorpora los aspectos dinámicos (por ejemplo: difusión, recambio, intercambio e interacciones moleculares) que se presentan en, o se dan entre, los elementos constitutivos de las biomembranas (7, 8). En 1972, Singer y Nicolson (7) incluyeron esta novedosa perspectiva en su conocido modelo de mosaico fluido, al postular que la membrana plasmática está constituida por una bicapa fluida de lípidos capaz de alojar diversos conglomerados o mosaicos proteicos. Estos últimos, pueden estar parcialmente inmersos, o bien, pueden atravesar la bicapa lipídica y, en ambos casos, protruir de ella. El modelo de mosaico fluido, adicionalmente, resalta las interacciones hidrófobas que se establecen entre las proteínas y los lípidos constitutivos de la membrana, así como la distribución aleatoria que ambos elementos guardan como resultado de su difusión en el plano de la membrana. Posterior a su planteamiento, surgieron diversas observaciones y críticas a este modelo. Por ejemplo, estudios sobre las propiedades mecano-químicas de las membranas de eritrocitos indicaron que los parámetros intrínsecos de los materiales de la membrana (por ejemplo: densidad, módulo elástico, viscosidad, energía libre superficial y módulo de deformación) mostraban diferencias significativas con respecto a los observados en bicapas lipídicas artificiales. Este hallazgo resultaba inconsistente con el modelo de mosaico fluido, ya que una biomembrana conteniendo estructuras proteicas muy separadas (a manera de icebergs) y sin restricción de movimiento, se esperaría que exhibiera propiedades muy semejantes a la de una bicapa lipídica artificial. Cuestionamientos de este tipo promovieron diversas modificaciones al modelo original. Así, por ejemplo, se incorporó la noción de asimetría entre las dos monocapas de la membrana (9, 10) y se resaltó la naturaleza selectiva de las interacciones moleculares que propician la difusión y segregación lateral de sus variados elementos lipídicos en dominios discretos (8, 11). Estos últimos, presentaron grandes dificultades en la definición de su tamaño, forma y vida media. Problemas que se adjudicaron, en gran medida, a la variabilidad entre ellos y entre las membranas que los alojaban (12). Una estrategia alternativa para su estudio consistió en caracterizar las fases lipídicas en equilibrio en modelos de membrana generados a partir de mezclas definidas de lípidos (por ejemplo: 2-3 componentes), asumiendo que dichas fases, conceptualmente, representaban sus análogos. La caracterización de estas fases en monocapas y bicapas sintéticas permitió establecer los principios termodinámicos que subyacen la segregación de fases inter e intramonocapas. Un modelo ampliamente utilizado en este tipo de estudios es el de las vesículas gigantes unilamelares. Estas bicapas lipídicas esféricas (diá- metro >20 μm) incorporan colorantes fluorescentes que se particionan de manera diferencial en las fases segregadas, permitiendo la discriminación de estas últimas a través de imágenes de microscopía de fluorescencia (13). 1.2. El modelo vigente: balsas de membrana El concepto de segregación de lípidos fue retomado por Simons y van Meer (1988) (14) en su modelo de microdominios lipídicos, el cual postularon a partir de sus estudios sobre la distribución diferencial de esfingolípidos hacia la membrana apical de células epiteliales. En dicho modelo, se plantea el ensamblaje de microdominios de esfingolípidos de manera específica en la monocapa luminal de la membrana del aparato de Golgi, donde operarían como centros de reclutamiento de aquellas proteínas destinadas a incorporarse a la monocapa externa de la membrana apical de dichas células. Un elemento adicional 128 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S al modelo de la estructura de las membranas bioló- gicas, el colesterol, fue incorporado más tarde por Simons e Ikonen (1997) (15) como un importante coorganizador de nanodominios o balsas lipídicas. El planteamiento de estos autores es que los complejos de glicoesfingolípidos-colesterol se mantienen estrechamente empaquetados y se comportan como unidades o balsas dentro de la monocapa externa de la membrana plasmática. A pesar que desde 1973 ya se habían expuesto consideraciones teóricas que predecían el que la fase ordenada de la monocapa externa podría inducir el empaquetamiento de regiones de la monocapa interna correspondiente, hasta mediados de los años 1990s la posible existencia de balsas se hallaba confinada a la monocapa externa de las membranas biológicas. Posteriormente, se ha mostrado que una organización equivalente de nanodominios está también presente en la monocapa citoplásmica (16), a pesar de que esta última es pobre en esfingolípidos, especialmente en esfingomielina (9,10). Sin embargo, ni su correspondencia física con las balsas de la monocapa externa, ni sus propiedades y componentes estructurales han sido totalmente caracterizados. Otro aspecto importante de este modelo tiene que ver con la interacción que se da entre proteínas y balsas lipídicas; donde sólo algunos elementos proteicos son incluidos o anclados a las balsas, mientras que otros son excluidos de sus límites en función de su naturaleza molecular y de sus propiedades termodinámicas (15). Más recientemente, se ha consensuado la redefinición del concepto de balsas lipídicas (lipid rafts) en favor del de balsas de membranas (membrane rafts): Las balsas de membrana son dominios pequeños (10-200 nm), heterogéneos, altamente dinámicos, enriquecidos en esteroles y esfingolípidos que compartimentan procesos celulares. Estas pequeñas balsas pueden, eventualmente, ser estabilizadas para formar plataformas de mayor tamaño a través de interacciones proteína-proteína y proteína-lípido (17). Es importante señalar que esta definición, dada la necesaria inclusión de esfingolípidos, excluye a los dominios ordenados de la capa interna de la membrana plasmática como balsas de membrana. A la fecha, se reconocen dos tipos de balsas de membrana: balsas planas y caveolas (18, Fig. 1). Las primeras están alineadas en el plano de la membrana y su caracterización ha sido muy difícil debido a su pequeño tamaño (10-200 nm) y gran dinamismo (17). Las caveolas, por su parte, corresponden a invaginaciones de la membrana plasmática (50-100 nm de diámetro) y, aun cuando están involucradas en los procesos de transcitosis y potocitosis, muestran un dinamismo mucho menor que el de las balsas planas (15). Una característica distintiva de las caveolas es su asociación con proteínas de soporte relativamente pequeñas (21-24 kDa) denominadas caveolinas, las cuales contribuyen a estabilizar su estructura a través de su interacción con la monocapa interna de la membrana plasmática. Las caveolinas funcionan como estructuras de andamiaje para diversas proteínas de señalización y como transportadores del colesterol (sintetizado de novo) desde el retículo endoplásmico hacia la membrana plasmática. Se han identificado tres isoformas de caveolinas. Dos de ellas se expresan ubicuamente (Cav-1 y Cav-2), mientras que la expresión de la tercera (Cav-3) está restringida a miocitos cardiacos y esqueléticos (19). En neuronas, las caveolinas generalmente están ausentes, aunque se ha reportado un grupo de proteínas análogas denominadas flotilinas (18). La significancia funcional de las balsas lipídicas es un tema vigente y de gran interés debido a la propuesta de que la compartimentación subcelular de procesos podría acompañarse de un incremento en su especificidad y eficiencia (18, 20). 1.3. Problemas del modelo de balsas de membrana Una crítica inicial muy fuerte al modelo de balsas tiene que ver con el aislamiento y caracterización de los dominios de membrana resistentes a detergentes (MRDs), definidos operacionalmente como balsas lipídicas (21). Diversos autores han argumentado que los MRDs corresponden a agregados de dominios de membranas promovidos por las condiciones establecidas durante su aislamiento (es decir, uso de Tritón X-100 a 4oC; ambos tratamientos inducen cambios de fase) y no necesariamente al estadio que tales dominios pudieran haber guardado previo a su aislamiento (22). Otro cuestionamiento importante se refiere a la localización que guardan las proteínas transmembranales (por ejemplo: receptores, canales iónicos, ATPasas o acarreadores) en el plano de la membrana. Con respecto a la posibilidad de que su inserción pudiera darse al interior de las balsas de membrana, se han esgrimido argumentos termodinámicos que señalan la baja probabilidad de este evento (23). Sin embargo, también existe un cúmulo de evidencias bioquímicas y biofísicas que sustenta su inserción en tales dominios de la membrana (18, 24, 25). Más aún, se ha propuesto que su incorporación pudiera ser un factor clave en el establecimiento y patrón de distribución de las balsas en la membrana plasmática (20). El ensamble de ciertas proteínas al interior de las balsas de membrana pudiera ser, asimismo, condición indispensable para promover su funcionalidad (26). Una hipótesis muy provocativa con REB 29(4): 125-134, 2010 La membrana plasmática: modelos, balsas y señalización 129 relación al proceso de incorporación de proteínas a las regiones ordenadas de la membrana refiere a un proceso jerárquico (20, 24) en el que la etapa inicial correspondería a la asociación de proteínas individuales con una cubierta o monocapa lipídica (lipid shell) enriquecida en glicoesfingolípidos y colesterol (~7 nm), lo que facilitaría su incorporación a balsas de membrana de mayor tamaño (50-200 nm) y eventualmente, su confluencia en plataformas funcionales asociadas a procesos de señalización y/o tráfico de membranas. Finalmente, tampoco se descarta la posibilidad de que las proteínas transmembranales pudieran localizarse en la frontera común entre las regiones desordenadas y las balsas de membrana. Con respecto a las denominadas proteínas periféricas (no transmembranales) asociadas a la membrana plasmática, es generalmente aceptado que éstas se particionan en los dominios ordenados y/o las MRDs como resultado de su fuerte anclaje a la monocapa exterior a través de anclas lipídicas de glicosilfosfatidilinositol (GPI) o bien, mediante su asociación a la monocapa interna vía procesos de acilación o prenilación (16) (Fig. 1). Ejemplos representativos de proteínas periféricas asociadas a la monocapa interna de la membrana plasmática son las proteínas de la familia Src, la subunidad β de las proteínas G, las flotilinas (a través de sus procesos de acilación), caveolinas (mediante su unión al colesterol) y anexinas (por medio de su asociación con fosfolípidos). 2. Lipidómica de las biomembranas El contenido total de colesterol y de fosfolípidos (incluyendo el tipo de ácidos grasos que los componen) en la membrana plasmática y membranas intracelulares está bien caracterizado en distintos Figura 1. Tipos de balsas de membrana. La membrana plasmática incluye dos tipos de balsas de membrana: planas y caveolas. En ambos, se destaca la presencia de colesterol, esfingomielina y proteínas asociadas. Se ilustra también la localización específica de caveolina en caveolas. 130 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S tejidos, tipos celulares y organelos intracelulares (12, 27, 28). En general, el porcentaje de colesterol alojado en la membrana plasmática es significativamente mayor (~25% del total de lípidos) al del aparato de Golgi (~8%), retículo endoplásmico rugoso (~6%), retículo endoplásmico liso (~10%) o mitocondrias (~3%) (12, 28, 29). La innegable relevancia de la lipidómica de membranas bioló- gicas conocida a la fecha, desafortunadamente es eclipsada por la mínima proporción de elementos comúnmente referidos (<15), no obstante la amplia gama de especies lipídicas (~1000) que se plantea está presente en estas membranas (30). Sin lugar a dudas, resulta indispensable ampliar nuestra actual perspectiva de la asociación de procesos celulares con los elementos lipídicos de las membranas biológicas. 3. Asimetría lipídica de las membranas Las primeras evidencias de la distribución asimétrica de lípidos en membranas biológicas se obtuvieron a partir de experimentos realizados en eritrocitos expuestos a fosfolipasas y esfingomielinasas (9, 10). El compendio de estos y posteriores reportes ha llevado a concluir que la monocapa externa de la membrana plasmática está compuesta principalmente de fosfatidilcolina y esfingomielina, mientras que la monocapa interna preferentemente incluye fosfatidilserina y fosfatidiletanolamina (Fig. 2). Los glicoesfingolípidos de la monocapa externa usualmente poseen un ácido graso de cadena larga (18-24 carbonos) que interacciona con las cadenas acílicas de los lípidos de la monocapa interna de la membrana. Lateralmente, se asocian entre sí a través de puentes de hidrógeno y de las interacciones débiles que se establecen entre sus carbohidratos. Por su parte, aquellas regiones de la membrana que exhiben un mayor grado de fluidez generalmente involucran moléculas de fosfatidilcolina con ácidos grasos insaturados. Se acepta que las regiones Figura 2. Asimetría lipídica de la membrana plasmática. Estructura química y porcentaje constitutivo de los principales lípidos de la membrana plasmática en sus monocapas externa e interna. REB 29(4): 125-134, 2010 La membrana plasmática: modelos, balsas y señalización 131 ordenadas y fluidas pueden intercalarse en el plano de la membrana plasmática. La asimetría lipídica también está presente en la membrana del aparto de Golgi y de endosomas. En contraste, ésta no se observa en la membrana del retículo endoplásmico (30). La asimetría lipídica entre las monocapas de las biomembranas se genera a través de distintos procesos: transferencia espontánea de componentes lipídicos entre las monocapas (flip-flop), actividad de ATP-asas transportadoras de especies lipídicas y retención específica de ciertos lípidos en una u otra de las monocapas. La distribución asimétrica de los lípidos reviste gran importancia, ya que previene el desarrollo de ciertos tipos de síndromes autoinmunes que pudieran comprometer la integridad de la membrana plasmática y, por lo tanto, la viabilidad celular. El patrón de distribución de colesterol entre las monocapas es un aspecto que a la fecha no está del todo dilucidado; existen reportes que lo ubican de manera preferente en la monocapa interna de la membrana plasmática, otros que lo sitúan principalmente en la monocapa externa o, incluso, aquellos que sostienen que su rápida trasferencia entre las dos monocapas propicia su distribución homogénea (29). 4. Viscosidad de la membrana La viscosidad es una propiedad de los fluidos que provee información acerca de su orden molecular. En el caso de las membranas biológicas este parámetro varía entre 1.5 y 3.8 P (P, poise = 1 g·cm−1·s−1), dependiendo del tipo celular (12), mientras que en la fase fluida del citoplasma (en ausencia de colisiones o uniones a macromoléculas citoplásmicas del indicador de viscosidad) su valor es similar al del agua: 0.007 P, a 37oC. La monocapa externa de la membrana posee una menor viscosidad que su contraparte interna (31) y cada una de ellas, a su vez, presenta un gradiente de viscosidad decreciente de la periferia hacia el centro (31). Interesantemente, la incorporación de colesterol modula en ambos sentidos la viscosidad Figura 3. Efecto dual del colesterol sobre la viscosidad de bicapas lipídicas. El colesterol disminuye o aumenta la viscosidad de bicapas lipídicas al incorporarse a regiones en fase cristalina o líquido-desordenado, respectivamente. Las cadenas aciladas de la fase resultante líquido-ordenado presentan menor movimiento térmico que las de la fase líquido-desordenado. Nótese que los cambios de temperatura indicados (± Calor) traspasan su valor crítico (Tc) o de transición. Ts representa la temperatura del sistema. Diagrama modificado de Chapman (36). . 132 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S de las bicapas lipídicas en función de la fase en que se encuentren las cadenas aciladas; la disminuye al actuar sobre fases cristalinas (Lβ) y la aumenta al incorporase a la fase de líquido-desordenado (Lα) (26, 32) (Fig. 3). Mediante la técnica de 31P-NMR (resonancia magnética nuclear) se ha demostrado que la presencia de colesterol disminuye de manera importante la difusión lateral de fostatidilcolina en liposomas. El efecto promotor de orden del colesterol se adjudica primordialmente a su estructura tetracíclica, la cual favorece su interacción con ácidos grasos saturados en conformación all-trans (26, 32). Este aumento en la viscosidad de la membrana se acompaña de un incremento en su grosor, una reducción en su permeabilidad a compuestos hidrófilos y la segregación de algunos de sus componentes debido al desfasamiento (mismatch) hidrófobo generado por la incorporación del colesterol. La reducción de la permeabilidad a compuestos hidrófilos por la adición de colesterol a bicapas lipídicas se puede explicar por el efecto aditivo o la interacción de los siguientes mecanismos: a) Efecto condensante del colesterol que promueve una reducción en el área molecular de los fosfolípidos; en ausencia de colesterol las moléculas de fosfolípidos (a 0oC) ocupan un área de 0.60 nm2 y con colesterol 0.51 nm2. b) Formación de un cinturón de puentes de hidrógeno en la interfase de la bicapa entre el 3β-hidroxilo del colesterol, el carbonilo del ácido graso esterificado y el agua. Aproximadamente, 11 moléculas de agua se unen al grupo polar de un fosfolípido en la bicapa. A partir de mediciones de la capacitancia eléctrica de liposomas se ha determinado que (partiendo del extremo carbonilo) las moléculas de agua penetran la bicapa hasta alcanzar el tercer o cuarto residuo metileno. En consistencia con lo anterior, estudios de resonancia del spin del electrón (ESR) sugieren Figura 4. Balsas de membrana y señalización. Las balsas de membrana favorecen la transducción de señales extracelulares al actuar como estructuras de andamiaje donde convergen distintos elementos implicados en las vías de señalización. REB 29(4): 125-134, 2010 La membrana plasmática: modelos, balsas y señalización 133 que las moléculas de agua penetran al menos hasta el segundo residuo metileno. c) La estructura tetracíclica rígida del colesterol restringe los movimientos de los carbonos 2º -10º de las cadenas aciladas que lo rodean, sin afectar la movilidad del metilo terminal de la cadena hidrocarbonada. La inserción de colesterol en regiones ordenadas de la membrana, en contraste, promueve su fluidez al inhibir el empaquetamiento de las cadenas acílicas de los ácidos grasos o su cristalización. Otros compuestos como esfingomielina, Ca2+ y Mg2+, también se ha reportado que modifican la viscosidad de las biomembranas (32). 5. Balsas de membrana y señalización Diversos estudios han adjudicado un papel importante a las balsas de membrana en la organización espacial y temporal de los distintos elementos involucrados en la transducción de señales extracelulares, apoptosis, infección viral, adhesión y migración celular, transmisión sináptica, organización del citoesqueleto y direccionamiento de proteínas durante los procesos de endocitosis y exocitosis (15, 18). Una estrategia ampliamente utilizada en la evaluación de estas tareas consiste en propiciar el desacople de los elementos constitutivos de las balsas de membrana (planas o caveolas) mediante el uso de fármacos que secuestran (por ejemplo: filipina, nistatina y anfotericina) o disminuyen (por ejemplo: metil-β-ciclodextrina) el colesterol alojado en las membranas celulares (Fig. 4). En el caso de las caveolas, su desmantelamiento también se logra al eliminar o interferir con el funcionamiento de sus proteínas constitutivas: las caveolinas. La efectividad de ambos procedimientos está bien documentada (18). Así por ejemplo, el pre-tratamiento con metil-β-ciclodextrina elimina la típica inhibición de los canales de potasio sensibles al voltaje (KV7.2/7.3) inducida por la estimulación de receptores muscarínicos (M1 o M3) co-expresados en células HEK293 (33). Por otra parte, se ha demostrado que la expresión de caveolina-3 en miocitos cardiacos es esencial para que se dé la modulación de los canales CaV1.2 (tipo L) por receptores β2-adrenérgicos (34). Finalmente, también se ha reportado que la desestabilización de las balsas puede afectar la expresión y/o la actividad (tanto en el sentido de pérdida como de ganancia de funciones) de diversas proteínas de membrana al modificar el ambiente lipídico que las rodea (33-35). 6. Conclusión El concepto de membrana plasmática ha cambiado radicalmente desde su propuesta inicial, basada en sus propiedades osmóticas, a finales del siglo XIX. La incorporación de diversas y novedosas características estructurales y funcionales a lo largo de estos años ha propiciado el establecimiento de un modelo dinámico que incluye la presencia de heterogeneidades denominadas balsas de membrana. Según este modelo, tales dominios representan plataformas estructurales lípido-proteicas que propician la eficiente modulación de procesos fisiológicos asociados a la membrana plasmática. Los principios que subyacen la dinámica de ensamblaje-disociación de las balsas de membrana, así como sus posibles repercusiones funcionales (como la señalización) en los diferentes ambientes y contextos celulares, incluso en las membranas intracelulares, actualmente son materia de intenso estudio.http://www.medigraphic.com/pdfs/revedubio/reb-2010/reb104d.pdf
La realización de este trabajo fue apoyada parcialmente por los siguientes convenios: CONACyT 61248 y C09-FRC-07-28.28-UASLP a U.M.; C10-FAI-05-46.75-UASLP a S.SA.; P/PIFI 2009-24MSU0011E-12 a U.M. y S.SA. REFERENCIAS 1. Jacobs ME (1962) Early osmotic history of the plasma membrane. Circulation 26:1013- 1021. 2. Fricke H (1923) The electric capacity of cell suspensions. Phys Rev Series II 21:708-709. 3. Gorter E, Grendel F (1925) On bimolecular layers of lipoids on the chromocytes of the blood. J Exp Med 41: 439-443. 4. Danielli JF, Harvey EN (1934) The tension at the surface of mackerel egg oil, with remarks on the nature of the cell surface. J Cell Comp Physiol 5: 483-494. 5. Danielli JF, Davson HA (1934) Contribution to the theory of permeability of thin films. J Cell Comp Physiol 5:495–508. 6. Robertson JD (1959) The ultraestructure of cell membranes and its derivatives. Biochem Soc Symp 16: 3-43. 7. Singer SJ, Nicolson GL (1972) The fluid mosaic model of the structure of cell membranes. Science 175:720-731. 8. Chapman D (1975) Phase transitions and fluidity characteristics of lipids and cell membranes. Quart Rev Biophys 8:185–235. 134 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S 9. Bretscher MS (1973) Membrane structure: some general principles. Science 181: 622- 629. 10. Rothman JE, Lenard J (1977) Membrane asymmetry. Science 195:743-753. 11. Jain MK, White HB (1977) Long range order in biomembranes. Adv Lipid Res. 15: 1-60. 12. Jain MK, Wagner RC (1980) Introduction to biological membranes. John Wiley and sons. New York. USA, p 382. 13. Akashi KI, Miyata H, Itoh H, Kinosita K (1996) Preparation of giant liposomes in physiological conditions and their characterization under an optical microscope. Biophys J 71: 3242-3250. 14. Simons K, van Meer G (1988) Lipid sorting in epithelial cells. Biochemistry 27: 6197-6202. 15. Simons K, Ikonen E (1997) Functional rafts in cell membranes. Nature 389: 569-572. 16. Zacharias DA, Violin JD, Newton AC, Tsien RY (2002) Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science 296: 913-916. 17. Pike LJ (2006) Rafts defined: a report on the keystone symposium on lipid rafts and cell function. J Lipid Res 47:1597-1598. 18. Allen JA, Halverson-Tamboli RA, Rasenick MM (2007) Lipid raft microdomains and neurotransmitter signalling. Nat Rev Neurosci 8:128-140. 19. Cohen AW, Hnasko R, Schubert W, Lisanti MP (2004) Role of caveolae and caveolins in health and disease. Physiol Rev 84:1341- 1379. 20. Ligwood D, Simons K (2010) Lipid rafts as a membrane-organizing principle. Science 327: 46-50. 21. Brown DA, Rose JK (1992) Sorting of GPIanchored proteins to glycolipids-enriched membrane subdomains during transport to the apical cell surface. Cell 68: 533-544. 22. Munro S (2003) Lipid rafts: elusive or illusive? Cell 115: 377-388. 23. Fastenberg ME, Shogomori H, Xu X, Brown DA, London E (2003) Exclusion of a transmembrane-type peptide from ordered-lipid domains (rafts) detected by fluorescence quenching: extension of quenching analysis to account for the effects of domain size and domain boundaries. Biochemistry 42:12376– 12390. 24. Anderson RG, Jacobson K (2002) A role for lipid shells in targeting proteins to caveolae, rafts, and other lipid domains. Science 296:1821-1825. 25. Jacobson K, Mouritsen OG, Anderson RG (2007) Lipid rafts: at a crossroad between cell biology and physics. Nat Cell Biol 9:7-14. 26. Simons K, Vaz WL (2004) Model systems, lipid rafts, and cell membranes. Annu Rev Biophys Biomol Struct 33: 269-295. 27. White AD (1973) The phospholipid composition of mammalian tissue. En Form and function of phospholipids. Ed. Ansell GB, Hawthorne JN y Dawson RMC. BBA Library Vol 3. Elsevier Scientific Publishing Co. New York USA, pp. 441-478. 28. McMurray WC (1973). Phospholipids in subcellular organelles and membranes. En Form and function of phospholipids. Ed. Ansell GB, Hawthorne JN y Dawson RMC. BBA Library Vol 3. Elsevier Scientific Publishing Co. New York USA, pp. 205-246. 29. Ikonen E (2008) Cellular cholesterol trafficking and compartmentalization. Nat Rev Mol Cell Biol 9:125-138. 30. van Meer G, Voelker DR, Feigenson GW (2008) Membrane lipids: where they are and how they behave. Nat Rev Mol Cell Biol 9:112-124. 31. Schachter D, Abbott RE, Cogan U, Flamm M (1983) Lipid fluidity of the individual hemileaflets of human erythrocyte membranes. Ann N Y Acad Sci 414:19-28. 32. Grant CWM (1983) Lateral phase separations and the cell membrane. En Membrane Fluidity in Biology. Vol. 2. General Principles. Ed. Aloia R.C. Academic Press. New York USA, pp. 131-150. 33. Oldfield S, Hancock J, Mason A, Hobson SA, Wynick D, Kelly E, Randall AD, Marrion NV (2009) Receptor-mediated supression of potassium currents requires colocalization within lipid rafts. Mol Pharmacol 76:1279-1289. 34. Balijepalli RC, Foell JD, Hall DD, Hell JW, Kamp TJ (2006) Localization of cardiac L-type Ca2+ channels to a caveolar macromolecular signaling complex is required for β2-adrenergic regulation. Proc Natl Acad Sci USA 103: 7500-7505. 35. Pontier SM, Percherancier Y, Galandrin S, Breit A, Gales C, Bouvier M (2008) Cholesterol-dependent separation of the β2-adrenergic receptor from its partners determines signaling efficacy: insight into nanoscale organization of signal transduction. J Biol Chem 283: 24659- 24672. 36. Chapman D (1973). Physical Chemistry of Phospholipids. En Form and function of phospholipids. Ed. Ansell GB, Hawthorne JN y Dawson RMC. BBA Library Vol 3. Elsevier Scientific Publishing Co. New York USA, pp. 117-141.
RESUMEN La membrana plasmática es la estructura que delimita a la célula. Inicialmente conceptualizada como una barrera inerte, divisoria del interior y exterior celular, en la actualidad se le reconoce como un elemento dinámico y fundamental en el mantenimiento de la integridad de la célula. Su plétora de componentes lipídicos y proteicos propicia su participación en muy diversos e importantes procesos por ejemplo: transporte y permeabilidad selectiva de sustancias e iones, excitabilidad, movilidad, diferenciación, exocitosis, reconocimiento intercelular y transducción de señales extracelulares. La presente revisión incluye un breve recuento de los principales modelos que han conducido a la concepción actual de su estructura y de sus propiedades funcionales y destaca las implicaciones del modelo vigente de balsas de membrana en procesos de señalización intracelular.
ABSTRACT The plasma membrane is the structure that delimits the cell. Originally, it was just considered a physical barrier that separates the inside from the outside of the cell. But now, it is visualized as a dynamic structure, enclosing diverse lipids and proteins elements, which is involved in several important processes e.g., ion permeability and transport, excitability, cell migration, hormone and neurotransmitter secretion, extracellular signal transduction, cell differentiation, and cell to cell recognition. This review contains a brief overview of the development of the plasma membrane concept, including its current model that involves the dynamic nanoscale heterogeneities denominated membrane rafts. The functional relevance of membrane rafts is also discussed. *Recibido: 14 de junio de 2010 Aceptado: 28 de octubre de 2010 REB 29(4): 125-134, 2010 125 PALABRAS CLAVE: Balsas lipídicas, caveolas, señalización, colesterol Departamento de Fisiología. Facultad de Medicina. Universidad Autónoma de San Luis Potosí. Av. Venustiano Carranza # 2405. San Luis Potosí, SLP. CP. 78210. México. Correo E: umeza@uaslp.mx, armass@uaslp.mx KEY WORDS: Lipid rafts, caveolae, signaling, cholesterol LA MEMBRANA
PLASMÁTICA: MODELOS, BALSAS Y SEÑALIZACIÓN* 1. Origen y desarrollo del concepto de membranas biológicas Una de las primeras referencias al concepto de membrana biológica se adjudica al botánico alemán Pfeffer (1887) (1), quien lo habría postulado al describir la similitud del comportamiento osmótico entre células y membranas artificiales (Tabla 1). En particular, Pfeffer observó que las propiedades osmóticas exhibidas por las membranas de algunos tipos de células vegetales semejaban a las de las membranas obtenidas al precipitar ferrocianuro cúprico sobre paredes porosas de cerámica. Posteriormente, Overton (1899) (1) demostró que las sustancias lipofílicas penetraban la célula con mayor facilidad que aquellas que no lo eran, lo que le llevó a concluir que la estructura que delimita a la célula debería estar constituida por una capa lipídica. Más tarde, el valor de la capacitancia eléctrica de la membrana plasmática fue reportado. En este sentido, Fricke (1923) (2) determinó el valor de 1.0 µF·cm-2 para la membrana de eritrocitos, mientras que en otros tipos celulares el valor fluctuó entre 1.0 y 6.0 µF·cm-2. Esta aparente inconsistencia fue adjudicada a la variabilidad en el espesor de las membranas analizadas. En su estudio clásico, Gorter y Grendel (1925) (3) determinaron el valor del área ocupada por los lípidos extraídos a partir 126 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S Año Autores Observación Ref. 1887 Pfeffer Similitud del comportamiento osmótico entre células vegetales y membranas artificiales. 1 1899 Overton Naturaleza lipídica de la membrana plasmática. 1 1923 Fricke Determinación del valor de capacitancia eléctrica específica de la membrana plasmática. 2 1925 Gorter y Grendel Organización de los lípidos de la membrana plasmática en bicapa. 3 1934 Danielli y Harvey Presencia de proteínas en la membrana plasmática. 4 Danielli y Davson Teoría paucimolecular de las biomembranas. 5 1959 Robertson Teoría unitaria de las membranas biológicas. 6 1972 Singer y Nicolson Modelo del mosaico fluido. 7 1975 Chapman Segregación de dominios lipídicos en el plano lateral de la membrana. 8 1988 Simons y van Meer Existencia de microdominios de esfingolípidos. 14 1997 Simons e Ikonen Modelo de balsas lipídicas e importancia del colesterol como elemento de las mismas. 15 2002 Anderson y Jacobson Incorporación de proteínas a balsas lipídicas a través de un proceso jerárquico. 24 Zacharias y cols. Presencia de nanodominios lipídicos en la monocapa interna de la membrana plasmática sin correspondencia necesaria con balsas lipídicas en la capa externa. 16 2006 Pike Sustitución del concepto de balsa lipídica por el de balsa de membrana. 17 2010 Ligwood y Simons Revaloración del modelo de balsas como principio organizador de las funciones de las membranas biológicas. 20 TABLA 1 CRONOLOGÍA DEL MODELO DE LA MEMBRANA PLASMÁTICA de la membrana plasmática de eritrocitos e inesperadamente, encontraron que dicho valor correspondía al doble del de la superficie calculada para un número conocido de estas células (asumiendo una forma discoidal para ellas). Estos investigadores infirieron, acertadamente, que la membrana de los eritrocitos está constituida por una bicapa de lípidos con un espesor de 5.0 – 6.0 nm. Posteriormente, al comparar la tensión superficial de la membrana plasmática de ovocitos de erizo de mar (0.2 dinas·cm-1) con la de una interfase artificial lípidosolución acuosa (10.0 -15.0 dinas·cm-1), Danielli y Harvey (1934) (4) evidenciaron el requerimiento de un factor adicional que explicaba la atenuación de este parámetro en las membranas biológicas, el cual adjudicaron a la presencia de proteínas. Otro avance significativo en la consolidación del concepto de biomembrana se atribuye a Danielli y Davson (1934) (5), quienes propusieron la teoría paucimolecular de la membrana, según la cual las membranas biológicas presentan un grupo mínimo de constituyentes moleculares que incluye: una región central de naturaleza lipídica no polar y espesor variable, bordeada (a ambos lados) por una monocapa de fosfolípidos cuyos extremos polares estarían orientados hacia el exterior y una monocapa más externa de proteínas globulares. En 1959, Robertson (6) postuló la denominada teoría unitaria de la membrana, la cual establece que todas las membranas biológicas están constituidas por una REB 29(4): 125-134, 2010 La membrana plasmática: modelos, balsas y señalización 127 bicapa lipídica. El sustento de esta propuesta fueron imágenes de membranas celulares obtenidas por microscopía electrónica en las que era posible distinguir una región intermedia de baja densidad electrónica delimitada por estructuras periféricas de mayor densidad; la región intermedia correspondía a las cadenas hidrocarbonadas de los lípidos y las estructuras periféricas a los grupos hidrófilos de los lípidos y/o a las proteínas asociadas. El aná- lisis detallado de este tipo de imágenes permitió a Robertson hacer extensivo su modelo al conjunto de membranas intracelulares. El modelo unitario establecía, adicionalmente, que los componentes proteicos se alojan principalmente sobre las superficies de la bicapa lipídica y sólo una proporción muy reducida de su estructura se localiza en la región central hidrófoba de la membrana. Aún cuando este modelo definía a la bicapa lipídica como una barrera al libre flujo de iones y moléculas hidrófilas, no descartaba la posible presencia de canales acuosos a través de los cuales pudiese darse el transporte de estos materiales. Esto último, bajo la condición de que dichos canales, de existir, deberían expresarse en muy baja densidad ya que su presencia difícilmente era detectable en las micrografías electrónicas. 1.1. Propiedades dinámicas de las biomembranas Los modelos hasta aquí mencionados se refieren, básicamente, a las características estructurales estáticas de las membranas biológicas. Y no fue sino hasta finales de los años sesentas cuando surge el concepto de fluidez de membrana que incorpora los aspectos dinámicos (por ejemplo: difusión, recambio, intercambio e interacciones moleculares) que se presentan en, o se dan entre, los elementos constitutivos de las biomembranas (7, 8). En 1972, Singer y Nicolson (7) incluyeron esta novedosa perspectiva en su conocido modelo de mosaico fluido, al postular que la membrana plasmática está constituida por una bicapa fluida de lípidos capaz de alojar diversos conglomerados o mosaicos proteicos. Estos últimos, pueden estar parcialmente inmersos, o bien, pueden atravesar la bicapa lipídica y, en ambos casos, protruir de ella. El modelo de mosaico fluido, adicionalmente, resalta las interacciones hidrófobas que se establecen entre las proteínas y los lípidos constitutivos de la membrana, así como la distribución aleatoria que ambos elementos guardan como resultado de su difusión en el plano de la membrana. Posterior a su planteamiento, surgieron diversas observaciones y críticas a este modelo. Por ejemplo, estudios sobre las propiedades mecano-químicas de las membranas de eritrocitos indicaron que los parámetros intrínsecos de los materiales de la membrana (por ejemplo: densidad, módulo elástico, viscosidad, energía libre superficial y módulo de deformación) mostraban diferencias significativas con respecto a los observados en bicapas lipídicas artificiales. Este hallazgo resultaba inconsistente con el modelo de mosaico fluido, ya que una biomembrana conteniendo estructuras proteicas muy separadas (a manera de icebergs) y sin restricción de movimiento, se esperaría que exhibiera propiedades muy semejantes a la de una bicapa lipídica artificial. Cuestionamientos de este tipo promovieron diversas modificaciones al modelo original. Así, por ejemplo, se incorporó la noción de asimetría entre las dos monocapas de la membrana (9, 10) y se resaltó la naturaleza selectiva de las interacciones moleculares que propician la difusión y segregación lateral de sus variados elementos lipídicos en dominios discretos (8, 11). Estos últimos, presentaron grandes dificultades en la definición de su tamaño, forma y vida media. Problemas que se adjudicaron, en gran medida, a la variabilidad entre ellos y entre las membranas que los alojaban (12). Una estrategia alternativa para su estudio consistió en caracterizar las fases lipídicas en equilibrio en modelos de membrana generados a partir de mezclas definidas de lípidos (por ejemplo: 2-3 componentes), asumiendo que dichas fases, conceptualmente, representaban sus análogos. La caracterización de estas fases en monocapas y bicapas sintéticas permitió establecer los principios termodinámicos que subyacen la segregación de fases inter e intramonocapas. Un modelo ampliamente utilizado en este tipo de estudios es el de las vesículas gigantes unilamelares. Estas bicapas lipídicas esféricas (diá- metro >20 μm) incorporan colorantes fluorescentes que se particionan de manera diferencial en las fases segregadas, permitiendo la discriminación de estas últimas a través de imágenes de microscopía de fluorescencia (13). 1.2. El modelo vigente: balsas de membrana El concepto de segregación de lípidos fue retomado por Simons y van Meer (1988) (14) en su modelo de microdominios lipídicos, el cual postularon a partir de sus estudios sobre la distribución diferencial de esfingolípidos hacia la membrana apical de células epiteliales. En dicho modelo, se plantea el ensamblaje de microdominios de esfingolípidos de manera específica en la monocapa luminal de la membrana del aparato de Golgi, donde operarían como centros de reclutamiento de aquellas proteínas destinadas a incorporarse a la monocapa externa de la membrana apical de dichas células. Un elemento adicional 128 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S al modelo de la estructura de las membranas bioló- gicas, el colesterol, fue incorporado más tarde por Simons e Ikonen (1997) (15) como un importante coorganizador de nanodominios o balsas lipídicas. El planteamiento de estos autores es que los complejos de glicoesfingolípidos-colesterol se mantienen estrechamente empaquetados y se comportan como unidades o balsas dentro de la monocapa externa de la membrana plasmática. A pesar que desde 1973 ya se habían expuesto consideraciones teóricas que predecían el que la fase ordenada de la monocapa externa podría inducir el empaquetamiento de regiones de la monocapa interna correspondiente, hasta mediados de los años 1990s la posible existencia de balsas se hallaba confinada a la monocapa externa de las membranas biológicas. Posteriormente, se ha mostrado que una organización equivalente de nanodominios está también presente en la monocapa citoplásmica (16), a pesar de que esta última es pobre en esfingolípidos, especialmente en esfingomielina (9,10). Sin embargo, ni su correspondencia física con las balsas de la monocapa externa, ni sus propiedades y componentes estructurales han sido totalmente caracterizados. Otro aspecto importante de este modelo tiene que ver con la interacción que se da entre proteínas y balsas lipídicas; donde sólo algunos elementos proteicos son incluidos o anclados a las balsas, mientras que otros son excluidos de sus límites en función de su naturaleza molecular y de sus propiedades termodinámicas (15). Más recientemente, se ha consensuado la redefinición del concepto de balsas lipídicas (lipid rafts) en favor del de balsas de membranas (membrane rafts): Las balsas de membrana son dominios pequeños (10-200 nm), heterogéneos, altamente dinámicos, enriquecidos en esteroles y esfingolípidos que compartimentan procesos celulares. Estas pequeñas balsas pueden, eventualmente, ser estabilizadas para formar plataformas de mayor tamaño a través de interacciones proteína-proteína y proteína-lípido (17). Es importante señalar que esta definición, dada la necesaria inclusión de esfingolípidos, excluye a los dominios ordenados de la capa interna de la membrana plasmática como balsas de membrana. A la fecha, se reconocen dos tipos de balsas de membrana: balsas planas y caveolas (18, Fig. 1). Las primeras están alineadas en el plano de la membrana y su caracterización ha sido muy difícil debido a su pequeño tamaño (10-200 nm) y gran dinamismo (17). Las caveolas, por su parte, corresponden a invaginaciones de la membrana plasmática (50-100 nm de diámetro) y, aun cuando están involucradas en los procesos de transcitosis y potocitosis, muestran un dinamismo mucho menor que el de las balsas planas (15). Una característica distintiva de las caveolas es su asociación con proteínas de soporte relativamente pequeñas (21-24 kDa) denominadas caveolinas, las cuales contribuyen a estabilizar su estructura a través de su interacción con la monocapa interna de la membrana plasmática. Las caveolinas funcionan como estructuras de andamiaje para diversas proteínas de señalización y como transportadores del colesterol (sintetizado de novo) desde el retículo endoplásmico hacia la membrana plasmática. Se han identificado tres isoformas de caveolinas. Dos de ellas se expresan ubicuamente (Cav-1 y Cav-2), mientras que la expresión de la tercera (Cav-3) está restringida a miocitos cardiacos y esqueléticos (19). En neuronas, las caveolinas generalmente están ausentes, aunque se ha reportado un grupo de proteínas análogas denominadas flotilinas (18). La significancia funcional de las balsas lipídicas es un tema vigente y de gran interés debido a la propuesta de que la compartimentación subcelular de procesos podría acompañarse de un incremento en su especificidad y eficiencia (18, 20). 1.3. Problemas del modelo de balsas de membrana Una crítica inicial muy fuerte al modelo de balsas tiene que ver con el aislamiento y caracterización de los dominios de membrana resistentes a detergentes (MRDs), definidos operacionalmente como balsas lipídicas (21). Diversos autores han argumentado que los MRDs corresponden a agregados de dominios de membranas promovidos por las condiciones establecidas durante su aislamiento (es decir, uso de Tritón X-100 a 4oC; ambos tratamientos inducen cambios de fase) y no necesariamente al estadio que tales dominios pudieran haber guardado previo a su aislamiento (22). Otro cuestionamiento importante se refiere a la localización que guardan las proteínas transmembranales (por ejemplo: receptores, canales iónicos, ATPasas o acarreadores) en el plano de la membrana. Con respecto a la posibilidad de que su inserción pudiera darse al interior de las balsas de membrana, se han esgrimido argumentos termodinámicos que señalan la baja probabilidad de este evento (23). Sin embargo, también existe un cúmulo de evidencias bioquímicas y biofísicas que sustenta su inserción en tales dominios de la membrana (18, 24, 25). Más aún, se ha propuesto que su incorporación pudiera ser un factor clave en el establecimiento y patrón de distribución de las balsas en la membrana plasmática (20). El ensamble de ciertas proteínas al interior de las balsas de membrana pudiera ser, asimismo, condición indispensable para promover su funcionalidad (26). Una hipótesis muy provocativa con REB 29(4): 125-134, 2010 La membrana plasmática: modelos, balsas y señalización 129 relación al proceso de incorporación de proteínas a las regiones ordenadas de la membrana refiere a un proceso jerárquico (20, 24) en el que la etapa inicial correspondería a la asociación de proteínas individuales con una cubierta o monocapa lipídica (lipid shell) enriquecida en glicoesfingolípidos y colesterol (~7 nm), lo que facilitaría su incorporación a balsas de membrana de mayor tamaño (50-200 nm) y eventualmente, su confluencia en plataformas funcionales asociadas a procesos de señalización y/o tráfico de membranas. Finalmente, tampoco se descarta la posibilidad de que las proteínas transmembranales pudieran localizarse en la frontera común entre las regiones desordenadas y las balsas de membrana. Con respecto a las denominadas proteínas periféricas (no transmembranales) asociadas a la membrana plasmática, es generalmente aceptado que éstas se particionan en los dominios ordenados y/o las MRDs como resultado de su fuerte anclaje a la monocapa exterior a través de anclas lipídicas de glicosilfosfatidilinositol (GPI) o bien, mediante su asociación a la monocapa interna vía procesos de acilación o prenilación (16) (Fig. 1). Ejemplos representativos de proteínas periféricas asociadas a la monocapa interna de la membrana plasmática son las proteínas de la familia Src, la subunidad β de las proteínas G, las flotilinas (a través de sus procesos de acilación), caveolinas (mediante su unión al colesterol) y anexinas (por medio de su asociación con fosfolípidos). 2. Lipidómica de las biomembranas El contenido total de colesterol y de fosfolípidos (incluyendo el tipo de ácidos grasos que los componen) en la membrana plasmática y membranas intracelulares está bien caracterizado en distintos Figura 1. Tipos de balsas de membrana. La membrana plasmática incluye dos tipos de balsas de membrana: planas y caveolas. En ambos, se destaca la presencia de colesterol, esfingomielina y proteínas asociadas. Se ilustra también la localización específica de caveolina en caveolas. 130 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S tejidos, tipos celulares y organelos intracelulares (12, 27, 28). En general, el porcentaje de colesterol alojado en la membrana plasmática es significativamente mayor (~25% del total de lípidos) al del aparato de Golgi (~8%), retículo endoplásmico rugoso (~6%), retículo endoplásmico liso (~10%) o mitocondrias (~3%) (12, 28, 29). La innegable relevancia de la lipidómica de membranas bioló- gicas conocida a la fecha, desafortunadamente es eclipsada por la mínima proporción de elementos comúnmente referidos (<15), no obstante la amplia gama de especies lipídicas (~1000) que se plantea está presente en estas membranas (30). Sin lugar a dudas, resulta indispensable ampliar nuestra actual perspectiva de la asociación de procesos celulares con los elementos lipídicos de las membranas biológicas. 3. Asimetría lipídica de las membranas Las primeras evidencias de la distribución asimétrica de lípidos en membranas biológicas se obtuvieron a partir de experimentos realizados en eritrocitos expuestos a fosfolipasas y esfingomielinasas (9, 10). El compendio de estos y posteriores reportes ha llevado a concluir que la monocapa externa de la membrana plasmática está compuesta principalmente de fosfatidilcolina y esfingomielina, mientras que la monocapa interna preferentemente incluye fosfatidilserina y fosfatidiletanolamina (Fig. 2). Los glicoesfingolípidos de la monocapa externa usualmente poseen un ácido graso de cadena larga (18-24 carbonos) que interacciona con las cadenas acílicas de los lípidos de la monocapa interna de la membrana. Lateralmente, se asocian entre sí a través de puentes de hidrógeno y de las interacciones débiles que se establecen entre sus carbohidratos. Por su parte, aquellas regiones de la membrana que exhiben un mayor grado de fluidez generalmente involucran moléculas de fosfatidilcolina con ácidos grasos insaturados. Se acepta que las regiones Figura 2. Asimetría lipídica de la membrana plasmática. Estructura química y porcentaje constitutivo de los principales lípidos de la membrana plasmática en sus monocapas externa e interna. REB 29(4): 125-134, 2010 La membrana plasmática: modelos, balsas y señalización 131 ordenadas y fluidas pueden intercalarse en el plano de la membrana plasmática. La asimetría lipídica también está presente en la membrana del aparto de Golgi y de endosomas. En contraste, ésta no se observa en la membrana del retículo endoplásmico (30). La asimetría lipídica entre las monocapas de las biomembranas se genera a través de distintos procesos: transferencia espontánea de componentes lipídicos entre las monocapas (flip-flop), actividad de ATP-asas transportadoras de especies lipídicas y retención específica de ciertos lípidos en una u otra de las monocapas. La distribución asimétrica de los lípidos reviste gran importancia, ya que previene el desarrollo de ciertos tipos de síndromes autoinmunes que pudieran comprometer la integridad de la membrana plasmática y, por lo tanto, la viabilidad celular. El patrón de distribución de colesterol entre las monocapas es un aspecto que a la fecha no está del todo dilucidado; existen reportes que lo ubican de manera preferente en la monocapa interna de la membrana plasmática, otros que lo sitúan principalmente en la monocapa externa o, incluso, aquellos que sostienen que su rápida trasferencia entre las dos monocapas propicia su distribución homogénea (29). 4. Viscosidad de la membrana La viscosidad es una propiedad de los fluidos que provee información acerca de su orden molecular. En el caso de las membranas biológicas este parámetro varía entre 1.5 y 3.8 P (P, poise = 1 g·cm−1·s−1), dependiendo del tipo celular (12), mientras que en la fase fluida del citoplasma (en ausencia de colisiones o uniones a macromoléculas citoplásmicas del indicador de viscosidad) su valor es similar al del agua: 0.007 P, a 37oC. La monocapa externa de la membrana posee una menor viscosidad que su contraparte interna (31) y cada una de ellas, a su vez, presenta un gradiente de viscosidad decreciente de la periferia hacia el centro (31). Interesantemente, la incorporación de colesterol modula en ambos sentidos la viscosidad Figura 3. Efecto dual del colesterol sobre la viscosidad de bicapas lipídicas. El colesterol disminuye o aumenta la viscosidad de bicapas lipídicas al incorporarse a regiones en fase cristalina o líquido-desordenado, respectivamente. Las cadenas aciladas de la fase resultante líquido-ordenado presentan menor movimiento térmico que las de la fase líquido-desordenado. Nótese que los cambios de temperatura indicados (± Calor) traspasan su valor crítico (Tc) o de transición. Ts representa la temperatura del sistema. Diagrama modificado de Chapman (36). . 132 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S de las bicapas lipídicas en función de la fase en que se encuentren las cadenas aciladas; la disminuye al actuar sobre fases cristalinas (Lβ) y la aumenta al incorporase a la fase de líquido-desordenado (Lα) (26, 32) (Fig. 3). Mediante la técnica de 31P-NMR (resonancia magnética nuclear) se ha demostrado que la presencia de colesterol disminuye de manera importante la difusión lateral de fostatidilcolina en liposomas. El efecto promotor de orden del colesterol se adjudica primordialmente a su estructura tetracíclica, la cual favorece su interacción con ácidos grasos saturados en conformación all-trans (26, 32). Este aumento en la viscosidad de la membrana se acompaña de un incremento en su grosor, una reducción en su permeabilidad a compuestos hidrófilos y la segregación de algunos de sus componentes debido al desfasamiento (mismatch) hidrófobo generado por la incorporación del colesterol. La reducción de la permeabilidad a compuestos hidrófilos por la adición de colesterol a bicapas lipídicas se puede explicar por el efecto aditivo o la interacción de los siguientes mecanismos: a) Efecto condensante del colesterol que promueve una reducción en el área molecular de los fosfolípidos; en ausencia de colesterol las moléculas de fosfolípidos (a 0oC) ocupan un área de 0.60 nm2 y con colesterol 0.51 nm2. b) Formación de un cinturón de puentes de hidrógeno en la interfase de la bicapa entre el 3β-hidroxilo del colesterol, el carbonilo del ácido graso esterificado y el agua. Aproximadamente, 11 moléculas de agua se unen al grupo polar de un fosfolípido en la bicapa. A partir de mediciones de la capacitancia eléctrica de liposomas se ha determinado que (partiendo del extremo carbonilo) las moléculas de agua penetran la bicapa hasta alcanzar el tercer o cuarto residuo metileno. En consistencia con lo anterior, estudios de resonancia del spin del electrón (ESR) sugieren Figura 4. Balsas de membrana y señalización. Las balsas de membrana favorecen la transducción de señales extracelulares al actuar como estructuras de andamiaje donde convergen distintos elementos implicados en las vías de señalización. REB 29(4): 125-134, 2010 La membrana plasmática: modelos, balsas y señalización 133 que las moléculas de agua penetran al menos hasta el segundo residuo metileno. c) La estructura tetracíclica rígida del colesterol restringe los movimientos de los carbonos 2º -10º de las cadenas aciladas que lo rodean, sin afectar la movilidad del metilo terminal de la cadena hidrocarbonada. La inserción de colesterol en regiones ordenadas de la membrana, en contraste, promueve su fluidez al inhibir el empaquetamiento de las cadenas acílicas de los ácidos grasos o su cristalización. Otros compuestos como esfingomielina, Ca2+ y Mg2+, también se ha reportado que modifican la viscosidad de las biomembranas (32). 5. Balsas de membrana y señalización Diversos estudios han adjudicado un papel importante a las balsas de membrana en la organización espacial y temporal de los distintos elementos involucrados en la transducción de señales extracelulares, apoptosis, infección viral, adhesión y migración celular, transmisión sináptica, organización del citoesqueleto y direccionamiento de proteínas durante los procesos de endocitosis y exocitosis (15, 18). Una estrategia ampliamente utilizada en la evaluación de estas tareas consiste en propiciar el desacople de los elementos constitutivos de las balsas de membrana (planas o caveolas) mediante el uso de fármacos que secuestran (por ejemplo: filipina, nistatina y anfotericina) o disminuyen (por ejemplo: metil-β-ciclodextrina) el colesterol alojado en las membranas celulares (Fig. 4). En el caso de las caveolas, su desmantelamiento también se logra al eliminar o interferir con el funcionamiento de sus proteínas constitutivas: las caveolinas. La efectividad de ambos procedimientos está bien documentada (18). Así por ejemplo, el pre-tratamiento con metil-β-ciclodextrina elimina la típica inhibición de los canales de potasio sensibles al voltaje (KV7.2/7.3) inducida por la estimulación de receptores muscarínicos (M1 o M3) co-expresados en células HEK293 (33). Por otra parte, se ha demostrado que la expresión de caveolina-3 en miocitos cardiacos es esencial para que se dé la modulación de los canales CaV1.2 (tipo L) por receptores β2-adrenérgicos (34). Finalmente, también se ha reportado que la desestabilización de las balsas puede afectar la expresión y/o la actividad (tanto en el sentido de pérdida como de ganancia de funciones) de diversas proteínas de membrana al modificar el ambiente lipídico que las rodea (33-35). 6. Conclusión El concepto de membrana plasmática ha cambiado radicalmente desde su propuesta inicial, basada en sus propiedades osmóticas, a finales del siglo XIX. La incorporación de diversas y novedosas características estructurales y funcionales a lo largo de estos años ha propiciado el establecimiento de un modelo dinámico que incluye la presencia de heterogeneidades denominadas balsas de membrana. Según este modelo, tales dominios representan plataformas estructurales lípido-proteicas que propician la eficiente modulación de procesos fisiológicos asociados a la membrana plasmática. Los principios que subyacen la dinámica de ensamblaje-disociación de las balsas de membrana, así como sus posibles repercusiones funcionales (como la señalización) en los diferentes ambientes y contextos celulares, incluso en las membranas intracelulares, actualmente son materia de intenso estudio.http://www.medigraphic.com/pdfs/revedubio/reb-2010/reb104d.pdf
La realización de este trabajo fue apoyada parcialmente por los siguientes convenios: CONACyT 61248 y C09-FRC-07-28.28-UASLP a U.M.; C10-FAI-05-46.75-UASLP a S.SA.; P/PIFI 2009-24MSU0011E-12 a U.M. y S.SA. REFERENCIAS 1. Jacobs ME (1962) Early osmotic history of the plasma membrane. Circulation 26:1013- 1021. 2. Fricke H (1923) The electric capacity of cell suspensions. Phys Rev Series II 21:708-709. 3. Gorter E, Grendel F (1925) On bimolecular layers of lipoids on the chromocytes of the blood. J Exp Med 41: 439-443. 4. Danielli JF, Harvey EN (1934) The tension at the surface of mackerel egg oil, with remarks on the nature of the cell surface. J Cell Comp Physiol 5: 483-494. 5. Danielli JF, Davson HA (1934) Contribution to the theory of permeability of thin films. J Cell Comp Physiol 5:495–508. 6. Robertson JD (1959) The ultraestructure of cell membranes and its derivatives. Biochem Soc Symp 16: 3-43. 7. Singer SJ, Nicolson GL (1972) The fluid mosaic model of the structure of cell membranes. Science 175:720-731. 8. Chapman D (1975) Phase transitions and fluidity characteristics of lipids and cell membranes. Quart Rev Biophys 8:185–235. 134 Meza U, Romero-Méndez AC, Licón Y, Sánchez-Armáss S 9. Bretscher MS (1973) Membrane structure: some general principles. Science 181: 622- 629. 10. Rothman JE, Lenard J (1977) Membrane asymmetry. Science 195:743-753. 11. Jain MK, White HB (1977) Long range order in biomembranes. Adv Lipid Res. 15: 1-60. 12. Jain MK, Wagner RC (1980) Introduction to biological membranes. John Wiley and sons. New York. USA, p 382. 13. Akashi KI, Miyata H, Itoh H, Kinosita K (1996) Preparation of giant liposomes in physiological conditions and their characterization under an optical microscope. Biophys J 71: 3242-3250. 14. Simons K, van Meer G (1988) Lipid sorting in epithelial cells. Biochemistry 27: 6197-6202. 15. Simons K, Ikonen E (1997) Functional rafts in cell membranes. Nature 389: 569-572. 16. Zacharias DA, Violin JD, Newton AC, Tsien RY (2002) Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science 296: 913-916. 17. Pike LJ (2006) Rafts defined: a report on the keystone symposium on lipid rafts and cell function. J Lipid Res 47:1597-1598. 18. Allen JA, Halverson-Tamboli RA, Rasenick MM (2007) Lipid raft microdomains and neurotransmitter signalling. Nat Rev Neurosci 8:128-140. 19. Cohen AW, Hnasko R, Schubert W, Lisanti MP (2004) Role of caveolae and caveolins in health and disease. Physiol Rev 84:1341- 1379. 20. Ligwood D, Simons K (2010) Lipid rafts as a membrane-organizing principle. Science 327: 46-50. 21. Brown DA, Rose JK (1992) Sorting of GPIanchored proteins to glycolipids-enriched membrane subdomains during transport to the apical cell surface. Cell 68: 533-544. 22. Munro S (2003) Lipid rafts: elusive or illusive? Cell 115: 377-388. 23. Fastenberg ME, Shogomori H, Xu X, Brown DA, London E (2003) Exclusion of a transmembrane-type peptide from ordered-lipid domains (rafts) detected by fluorescence quenching: extension of quenching analysis to account for the effects of domain size and domain boundaries. Biochemistry 42:12376– 12390. 24. Anderson RG, Jacobson K (2002) A role for lipid shells in targeting proteins to caveolae, rafts, and other lipid domains. Science 296:1821-1825. 25. Jacobson K, Mouritsen OG, Anderson RG (2007) Lipid rafts: at a crossroad between cell biology and physics. Nat Cell Biol 9:7-14. 26. Simons K, Vaz WL (2004) Model systems, lipid rafts, and cell membranes. Annu Rev Biophys Biomol Struct 33: 269-295. 27. White AD (1973) The phospholipid composition of mammalian tissue. En Form and function of phospholipids. Ed. Ansell GB, Hawthorne JN y Dawson RMC. BBA Library Vol 3. Elsevier Scientific Publishing Co. New York USA, pp. 441-478. 28. McMurray WC (1973). Phospholipids in subcellular organelles and membranes. En Form and function of phospholipids. Ed. Ansell GB, Hawthorne JN y Dawson RMC. BBA Library Vol 3. Elsevier Scientific Publishing Co. New York USA, pp. 205-246. 29. Ikonen E (2008) Cellular cholesterol trafficking and compartmentalization. Nat Rev Mol Cell Biol 9:125-138. 30. van Meer G, Voelker DR, Feigenson GW (2008) Membrane lipids: where they are and how they behave. Nat Rev Mol Cell Biol 9:112-124. 31. Schachter D, Abbott RE, Cogan U, Flamm M (1983) Lipid fluidity of the individual hemileaflets of human erythrocyte membranes. Ann N Y Acad Sci 414:19-28. 32. Grant CWM (1983) Lateral phase separations and the cell membrane. En Membrane Fluidity in Biology. Vol. 2. General Principles. Ed. Aloia R.C. Academic Press. New York USA, pp. 131-150. 33. Oldfield S, Hancock J, Mason A, Hobson SA, Wynick D, Kelly E, Randall AD, Marrion NV (2009) Receptor-mediated supression of potassium currents requires colocalization within lipid rafts. Mol Pharmacol 76:1279-1289. 34. Balijepalli RC, Foell JD, Hall DD, Hell JW, Kamp TJ (2006) Localization of cardiac L-type Ca2+ channels to a caveolar macromolecular signaling complex is required for β2-adrenergic regulation. Proc Natl Acad Sci USA 103: 7500-7505. 35. Pontier SM, Percherancier Y, Galandrin S, Breit A, Gales C, Bouvier M (2008) Cholesterol-dependent separation of the β2-adrenergic receptor from its partners determines signaling efficacy: insight into nanoscale organization of signal transduction. J Biol Chem 283: 24659- 24672. 36. Chapman D (1973). Physical Chemistry of Phospholipids. En Form and function of phospholipids. Ed. Ansell GB, Hawthorne JN y Dawson RMC. BBA Library Vol 3. Elsevier Scientific Publishing Co. New York USA, pp. 117-141.
difusión facilitada
- BANIA ABIGAIL MARTÍNEZ RODRÍGUEZ
-TANIA GABRIELA SÁNCHEZ GALICIA
-MIRANDA MARTÍNEZ EDITH
- YULIZA ZUÑIGA SALGADO
EQUIPO 5
VER ARCHIVO ORIGINAL <---------- Mecanismos de transporte a través de la membrana explicados por medio de animaciones
Suscribirse a:
Entradas (Atom)